- 翰林提供学术活动、国际课程、科研项目一站式留学背景提升服务!
- 400 888 0080
IBDP化学课程真题讲解(6)
通常而言,IBDP 化学被视作一门比较难的学科。但对于一些小伙伴而言,IB化学却并不那么难。这两者并不矛盾。今天带着大家一起看一道IBDP化学课程的真题:选择题(HIGHER LEVEL PAPER 2)。这道题取自于IBDP chemistry specimen paper。不多说,直接上题。
题目1:
![]()
Sections 1 and 21 of the data booklet may be used for parts (b) to (e).
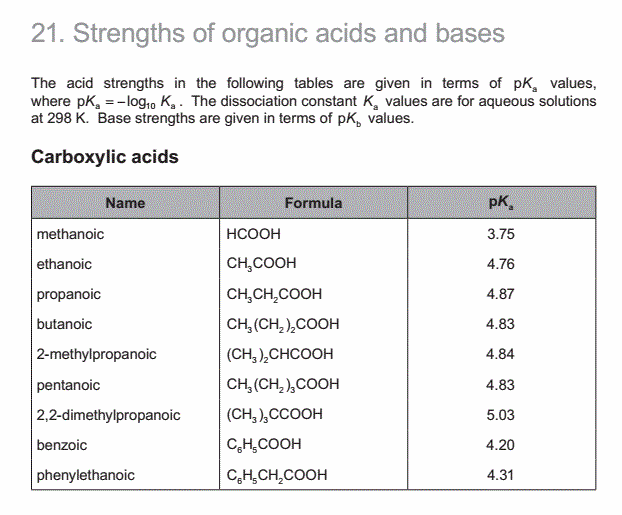
(b) Calculate the value of Ka, the acid dissociation constant at 298 K, for an aqueous solution of methanoic acid. [1]
题目难度:简单。
考点分析:考查pKa和Ka的换算。
题目分析:查data booklet 第21部分可知,methanoic acid的pKa是3.75,所以Ka=10^(-3.75)。
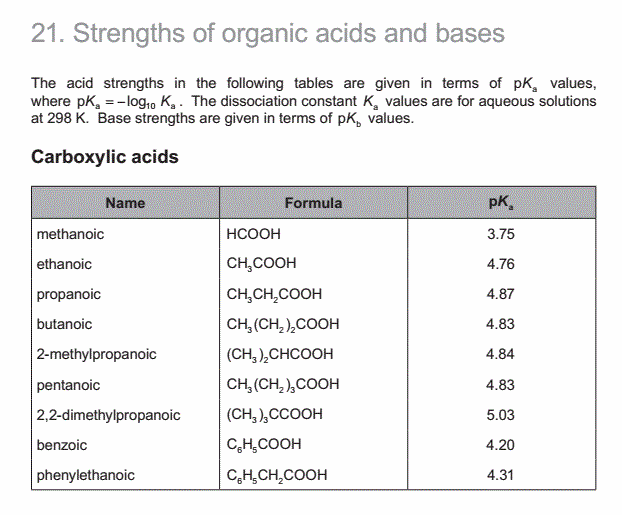
正确答案:
题目2:
![]()
Sections 1 and 21 of the data booklet may be used for parts (b) to (e).
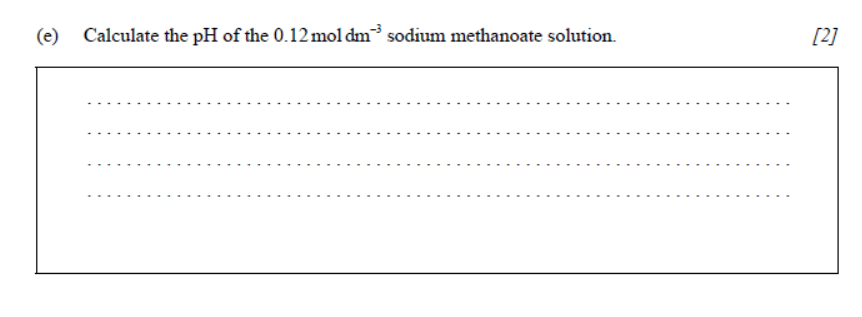
(c) Calculate the value of Kb, the base dissociation constant, for the conjugate base. [1]
题目难度:简单。
考点分析:考查Ka和Kb的关系。
题目分析:Ka乘以Kb等于Kw。Ka的值在(b)问已经求出来了,而Kw的值是知道的,所以Kb的值就可以求出来了。
正确答案:
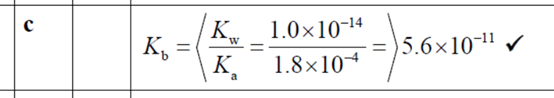
扫码添加翰林顾问老师,可一对一制定国际课程规划
【免费领取】IBDP/IB 备考资料合集~

题目1:
![]()
Sections 1 and 21 of the data booklet may be used for parts (b) to (e).

题目难度:简单。
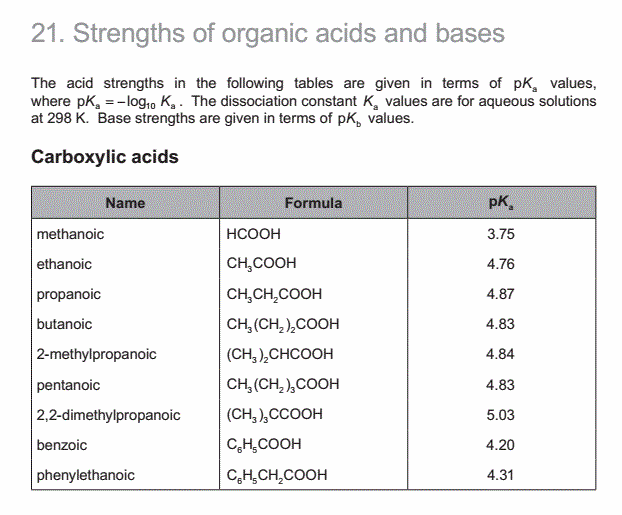
考点分析:考查弱酸根的水解以及Kb的运用。
题目分析:假设氢氧根的浓度和甲酸的浓度是一样的,假设甲酸钠的浓度不改变,基于此,可以根据Kb的表达式列式计算。
正确答案:

题目2:
![]()
Sections 1 and 21 of the data booklet may be used for parts (b) to (e).
题目难度:简单。
考点分析:考查pH的计算。
题目分析:上一问已经求出了OH的浓度,根据上一问算出的OH的浓度,先求出pOH,然后再根据pH+pOH=14求出pH。
正确答案:
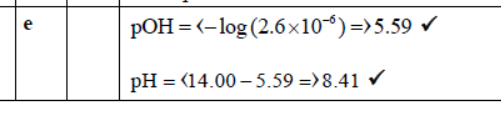

最新发布
© 2025. All Rights Reserved. 沪ICP备2023009024号-1








