- 翰林提供学术活动、国际课程、科研项目一站式留学背景提升服务!
- 400 888 0080
化学学习方法从AS到A2如何真正学懂Equilibirum
小提示:本文干货较多,请耐心并认真阅读对于Equilibrium的知识相信同学们无论在GCSE 还是在AL阶段都有一定程度的了解,并且在我们的印象中这并不是一个特别难懂或者难得分的知识点。
你以为知道Dynamic equilibrium 就够了?
知道怎么去判断Equilibrium shift就够了?
知道如何去求解两个Equilibrium constant就够了?
如果你这么想就太天真了!
在阶段,你要明白:
Chemical Equilibrium is an Dynamic Equilibrium,相信同学们对于这句话已经耳熟能详,没错,它告诉我们的就是化学平衡是一个动态平衡。
但是大部分同学们只是停留在这句话的背诵上,而没有真正的考虑它在真正告诉我们什么。
其实对于动态平衡的理解要从这两个方面出发:
第一,当我们说一个chemical reaction reaches equilibrium的时候,那么作为一个reversible reaction,rate of forward reactionrate of backward reaction。
也就是说,在可逆反应当中,当一个反应达到平衡之后,有多少反应物转化为生成物就有多少生成物转化回反应物。
第二,当我们说一个chemical reaction reaches equilibrium的时候,the concentrations of all the substance in the reaction stay the same. 注意,同学们对于这个same的理解有时候会出现偏差。
它指的并不是所有物质的concentration 都相等(equal)!而是在说当反应达到平衡的时候,the concentrations of all the substance in the reaction stay unchanged!
每一个substance 在平衡的时候都有自己的concentration并且这个concentration 保持不变,并不意味着所有的concentrations都相等!敲黑板!以上两个方面也是考试中Why chemical equilibrium is a dynamic equilibrium 的答案!
Le chatelier’s principle 是帮助我们判断化学反应平衡移动的重要规则,对于一个已经达到平衡的可以反应,conditions 的改变就会引起化学反应平衡的移动。
能够引起平衡移动的factors小编相信同学们已经非常熟悉了,它们分别是concentration, pressure(gaseous system),temperature (Endothermic or exothermic), 最后一个就是catalyst。
对于前面几个,相信同学们已经能够很好的判断平衡移动的方向了,在这儿小编要着重给同学们讲讲最后一个catalyst。
Catalyst并不能够引起平衡的移动,它只是可以让一个reaction能够快速的达到平衡状态。
当然,我们在学习catalyst的时候就提到过,并不是所有加catalyst的目的都是加速reaction,也有一些reaction 需要减慢速度,只是我们平时不常见而已。
一般在catalyst当中都有一个重要的组成部分,那就是transition metal,如果看到这个词,同学们脑海中一片空白的话,快去翻翻书,把这部分知识捡起来! 因为按照新的出题的趋势,各个topic之间的联系越来越大。
在一道题目中,只要能够涉及的知识点都非常有可能考到。
在A2阶段,这部分知识更是需要我们做更多的了解和学习。
首先就是一个量化的概念:Equilibrium constant
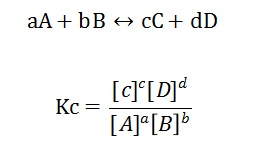
Kc就是这个reversible reaction的Equilibrium constant,[ ]代表这一个substance的concentration, 而a,b,c,d 则是这个reaction的balancing number。
注意!在记忆这个公式的时候一定要把它和rate equation 的计算公式区分开(order of the reaction)。
当然如果我们上面的ABCD都是Gas,那么这个Equilibrium constant也可以用Kp的形式来表达:
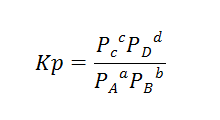
这里面,等等这些参数都是Partial pressure, 他们加起来就应该是整个这个system的total pressure 。
那么这样的话其实每一个partial pressure就非常好求啦,只需要用他们各自的fractional moles 去乘以total pressure 得到的就是每个substance各自的partial pressure.注意!
重点和易错的地方又来了,无论是Kc 还是Kp的计算,里面所用的concentration 和 partial pressure都是各个substance 在equilibrium 时候的value.也就是说我们要以计算的value,既不是start of the reaction 时候的,也不是during the reaction 的!在这里再次强调是因为同学们经常会在这里犯错而导致无谓的丢分。
一般来讲,对于一个excess reactant,equilibrium concentration往往是它after reaction 剩下的,而对于product 而言,equilibrium concentration 往往是它after the reaction 生成的。
小编在这儿再次提醒同学们在计算的时候尽量按照标准的三段式进行分析计算,即把start of the reaction, during the reaction 以及 equilibrium 这三个阶段的concentration都写在reaction 下面,然后所有的东西就都一目了然啦!
如果上面三个知识点同学们已经掌握的非常棒了,那我们就来看看最有一个问题,why le chatelier’s principle? 不知道同学们是否想过,我们可以用le chatelier’s principle 来判断一个equilibrium 的移动方向,但是为什么可以这样,有没有任何的theory可以支持这样的一个规则呢?
答案当然是肯定的,那就是我们上面讲的这个equilibrium constant. 注意,Kc 和Kp只受温度的影响,那么也就是说在温度不变的情况下,Kc 和Kp 是不变的!
那这样的结论为什么能够支持Le chatelier’s principle? 下面小编就为大家举个例子,让大家体验一下Equilibrium 的神奇。
我们就拿
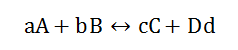
这个reaction来举例,如果现在Increase the concentration of A, 我们先不着急用Le chatelier’s principle来判断移动方向,我们先看看Kc 这时候会有什么变化
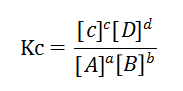
[A]如果突然增加,那么对于Kc来讲会马上decreace,形成一个新的Kc‘<Kc,我们说过当温度不变时,Kc是不变的,所以Kc’要变回到原来的Kc。
从数学角度来说,Kc’ 可以走的路有两条:一.让[B]decrease;二.让[C] ,[D] increase. 那我们再从chemical reaction 的角度来看看,[B]decrease; [C] ,[D] increase, 是不是刚刚好是让Equilibrium shifts to right 来实现的呢?
是不是刚刚好obey Le chatelier’s principle 呢?如果同学们有兴趣,可以自己去试试别的conditions,屡试不爽。
最后一次敲黑板!在新的出题模式下,这种题目类型是考官特别喜欢的!

最新发布
© 2026. All Rights Reserved. 沪ICP备2023009024号-1









