- 翰林提供学术活动、国际课程、科研项目一站式留学背景提升服务!
- 400 888 0080
A-level生物强大的酶—Enzyme
我们都知道酶enzyme是biological catalyst, 能极快的加速反应速率。大部分的酶是protein (globular protein), 有一小部分是RNA,称为ribozyme.所以,下面我们来总结一下酶的properties:
1. Enzyme as biological catalyst
2. Enzymes can be used repeatedly (酶可以重复使用)
3. A small amount of enzyme is required
4. Enzyme is a kind of protein
5. affected by temperature and pH value of the environment. (酶会被温度,pH等影响)
6. Enzymes possess specificity (酶具有特异性)
这是因为enzyme有一个特殊的区域称为活性部位(active site).由于substrate的形状与active site的形状高度契合(fit),因此substrate能够与active site特异性地结合,形成enzyme-substrate complex
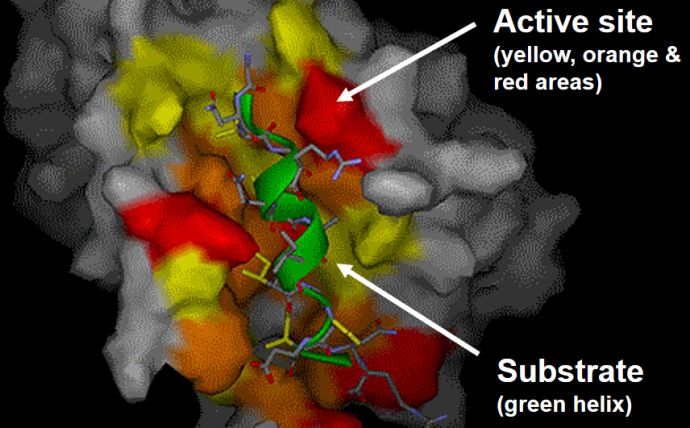
Enzyme 工作一共有两种mechanism: a. lock and key model and b. induced fit model
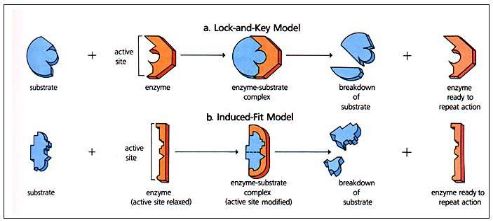
Lock and key model应该很好理解,substrate are exactly complimentary to enzyme active site.他们是一个完美的契合结构,像钥匙和锁一样。Induced fit mode是指当substrate结合到active site后,enzyme will change its structure,使得substrate和active site的结合更加地紧密,提高了酶的催化能力。
我们接下来讲一下chemical reaction.对于一个化学反应AB + CD → AC + BD, AB和CD是这个酶的substrate,或者称为substrate. 我们得到的AC和BD就是产物(product)
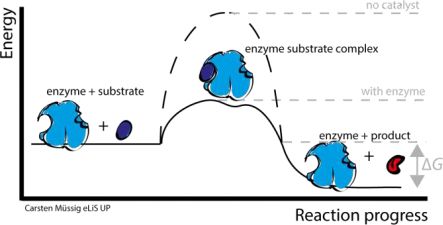
如图所示,底物所含有的总能量和产物所含有的总能量是不同的。
如果底物含有的总能量大于产物含有的总能量,那么该反应会释放能量,称为放能反应(exergonic reaction). 如果要让反应发生,要么从周围的环境中吸热,这部分能量是用于引发化学反应的能量被称为活化能(activation energy),缩写为EA。
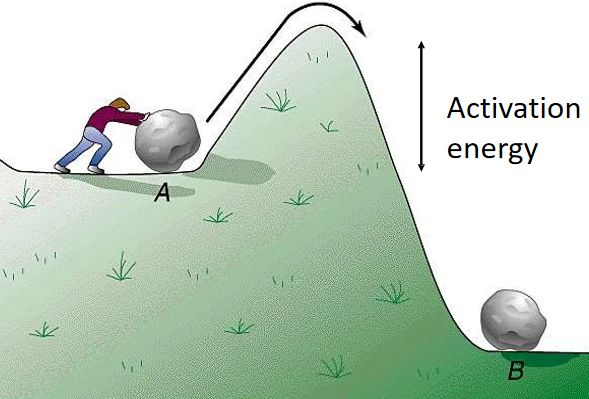
上图中的EA就像一个山丘,it is the minimum energy for a reaction to take place。那么酶是如何加速化学反应的呢?
答案是酶能够降低反应的EA,让山丘矮了些。所以‘Enzymes lowers the activation energy by holding the substrate or substrates in such a way that their molecules can react more easily’酶催化的反应将在较低的温度下迅速发生,一般能加速108到1011倍。
影响酶活性(enzyme activity)的因素:
1. 温度
在最适温度(optimal temperature)之前,随着温度的升高,分子运动加快,substrate与active site的碰撞的概率增大,但是超过optimal temperature维持enzyme tertiary structure的bonds如hydrogen bond, ionic bond被破坏,导致enzyme denature失去活性。人体酶的optimal temperature在37 °C。
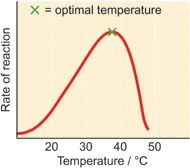
2. pH
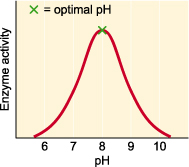
同理不同的enzyme有不同的optimal pH,当环境pH远远偏离酶的optimal pH时,比如强酸强碱的环境,enzyme 的结构会被破坏,so enzyme will denature.
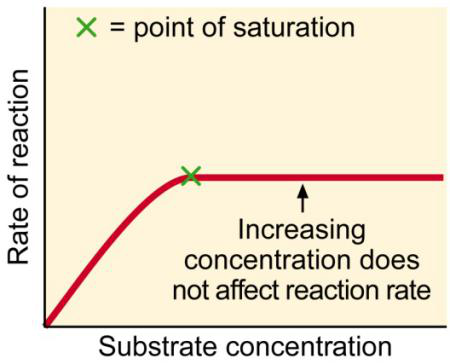
3. 底物浓度(substrate concentration)
Substrate concentration逐渐增加,enzyme activity也逐渐增加,直到超过enzyme的concentration时,reaction rate will not change.
4. 抑制剂(inhibitor)
细胞中酶的抑制剂通常与酶结合得不紧密,因此是可逆的(reversible)。可逆抑制剂根据其作用机理分为2种:竞争性抑制剂(competitive inhibitor)和非竞争性抑制剂(noncompetitive inhibitor)。
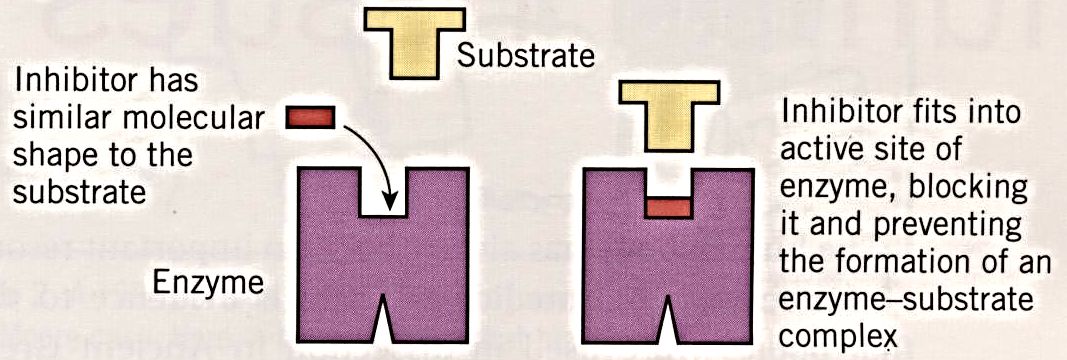
Competitive inhibitor的结构与substrate的结构相似 (similar structure),因此能够与substrate竞争active site,从而降低enzyme activity。如果我们不断增加substrate concentration competitive inhibitor竞争不过substrate,从而失去抑制能力。
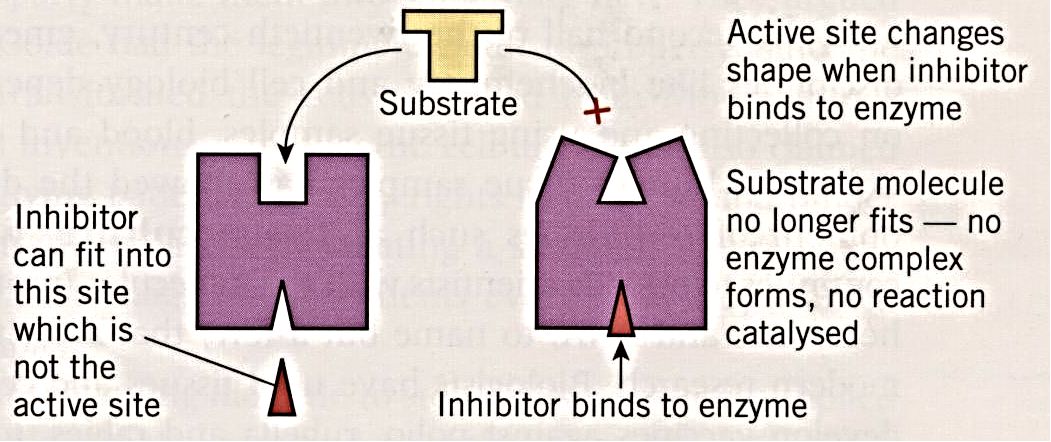
Noncompetitive inhibitor不与active site结合,它结合到enzyme上的一个叫做allosteric site的部位,使active site的形状发生改变,substrate无法与active site结合,从而降低enzyme activity。
以上就是关于enzyme的几个基本的考点。
期末复习,为帮助小伙伴们提升刷题效率,我们为大家准备了IG/A-level精品题库,涵盖数学、生物、物理、化学、经济五大热门科目。帮助学生提高刷题效率,反复强化,提升应用与解题能力,实现高分。
如果需要更多其他课程资料扫码【免费领取】福利!

早鸟钜惠!翰林2025暑期班课上线

最新发布
© 2025. All Rights Reserved. 沪ICP备2023009024号-1








