- 翰林提供学术活动、国际课程、科研项目一站式留学背景提升服务!
- 400 888 0080
【A-level化学】有机反应机理——化学反应的本质
要讲有机反应机理必须要先从最开始的化学反应的本质讲起
首先要提到的是electronegativity(电负性)和polarity(极性)
简单来说,电负性表示了在共价键中原子吸引电子的能力。一般我们认为(或者说初中老师交给我们)在共价键中,共享的电子对是在两个原子的正中间,但是事实上不是的。共用电子对其实会更靠近两个原子中电负性较大的原子(即吸引电子能力更强的电子):
![]()
于是由于电子更靠近上图中的B原子,那么B就带有轻微的负电荷,读作:delta negative;相应的,A带有一点点正电荷,读作:delta positive。A和B之间的这个共价键就称为极性共价键(polar bond)。这些很微小的电荷统称为dipole。按照Pauling scale,我们可以用数字0.7-4.0来表示每一个元素的电负性,电负性最大的是F,4.0;最小的是Cs,0.7。
电负性的总体趋势如下:
只要是电负性的不同的两个原子形成的共价键一定是极性共价键(polar),两个电负性相同的原子(一般来说即指由两个相同的原子,例如氧气O2)形成的共价键则是非极性共价键(non-polar)。
第二个需要引进的概念就是杂化
高中化学首先学习的内容就是atomic orbital,也就是俗称为“spdf”的东西(这个太基础了,我懒,略过,大概就是每一个electron shell里面其实都还有很多个sub-shells以及orbitals,他们分别叫s,p,d和f==)。每一个原子有自己的atomic orbital,但是在组成分子的时候原子原子之间的orbitals重叠过后形成了新的orbital,这个现象就成为杂化(hybridization)。高中会遇到的杂化分别是sp杂化,sp2杂化以及sp3杂化。从sp3杂化说起。sp3杂化最典型的例子就是甲烷CH4。在所有有机物中,碳原子的一个电子从2s轨道promote到了2pz轨道形成了4个unpaired electrons:
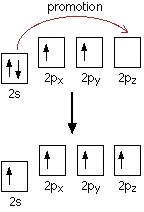
称在这个状态的碳原子:in its excited state
当碳原子“兴奋”了之后,3个在p轨道和s轨道杂化形成了四个新的轨道:
于是这四个新的格子包含一个电子的轨道就可以和四个H原子形成四个共价键:
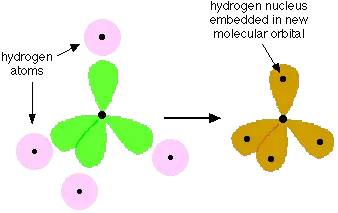
再根据电子互斥理论(说白了就是这四个共价键都看其他三个键不顺眼,于是他们互相离越远越好,以免掐架)然后就形成了tetrahedral shape的正四面体结构。相同的,sp2杂化形成的最典型的有机化合物就是包含碳碳双键的的乙烯CH2=CH2。sp2杂化即是两个p轨道与一个s轨道杂化形成的:

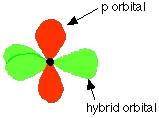
由图可见,剩下的一个2pz轨道(图中标红的)就是未杂化的轨道。当两个sp2杂化过的碳原子靠近的时候,他们的2pz轨道相互重合,形成了一个π键,即两个p轨道“肩并肩”重叠在一起。因此,这两个碳原子中间有两个键,一个是p轨道“头对头”重叠形成的σ键,另一个是“肩并肩”形成的π键。

同理可以推出sp杂化的原理以及最典型有机化合物乙炔的构成。sp杂化是仅有一个p轨道和一个s轨道杂化形成的,另外两个没有参与杂化的p轨道分别与另一个碳原子的两个未杂化p轨道“肩并肩”形成两个π键。因此碳碳三键包含一个σ键和两个π键。
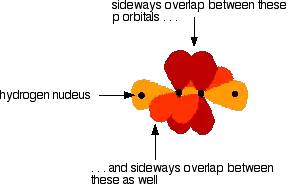
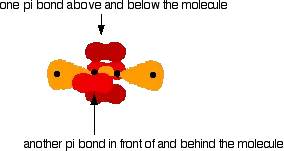
那么在有机化学中,几乎所有的反应都和这里讲到的极性、dipole、σ键和π键有直接或是间接的联系。弄懂了反应的本质,才可以更加快速的理解并记忆各种“奇奇怪怪”的有机反应机理。另外,作为常识请记住:由于π键的键能小于σ键,所以首先参与反应断裂的键为π键。
以上均为国内高中和国外高中重合内容,没有学过国内高中内容的童鞋们不懂的可以翻翻高中化学教材哟~
早鸟钜惠!翰林2025暑期班课上线

最新发布
© 2025. All Rights Reserved. 沪ICP备2023009024号-1








